ARE-Nrf2荧光素酶KeratinoSens™体外皮肤致敏试验标准操作程序
OECD 测试指南 442D 附录IA
概述
1. 目的
本标准操作程序(SOP)描述了ARE-Nrf2荧光素酶KeratinoSens™体外皮肤致敏试验方法,用于:
- 识别皮肤致敏化学品(UN GHS(1)),过敏和不过敏
- 评估化学品激活角质形成细胞的潜力
- 支持皮肤致敏危害识别
- 作为测试与评估整合策略(IATA)的组成部分
2. 原理
KeratinoSens™试验基于皮肤致敏不良结局路径(AOP)的第二个关键事件:
- 角质形成细胞激活通过Nrf2-ARE通路评估
- 荧光素酶报告基因在人AKR1C2基因抗氧化反应元件(ARE)控制下稳定转染
- 致敏剂机制:亲电性物质与Keap1蛋白的半胱氨酸残基共价结合,导致Nrf2释放
- Nrf2激活:释放的Nrf2转位至细胞核,结合ARE元件,启动下游基因转录
- 检测终点:荧光素酶活性作为Nrf2激活的定量指标
3. 适用范围
3.1 适用化学品类型
适用于以下化学品的测试:
- 化妆品成分
- 工业化学品
- 农药活性成分
- 药物成分
3.2 局限性
本方法不适用于或需要谨慎解释的情况:
- 仅与赖氨酸残基反应的物质(可能假阴性)
- 前半抗原(pro-haptens)和预半抗原(pre-haptens)
- 干扰荧光素酶活性的物质
- 在测试浓度下不溶解或不形成稳定分散的物质
材料与试剂
1. 细胞系
KeratinoSens™转基因细胞系
| 参数 | 规格 |
|---|---|
| 细胞类型 | 永生化人角质形成细胞(HaCaT) |
| 转染基因 | 在人AKR1C2基因ARE控制下的荧光素酶报告基因 |
| 获取方式 | 需签署标准协议(含商业使用许可) |
细胞质量控制:
- 支原体检测阴性
- 细胞形态正常
- 最大传代数:25代
- 定期进行荧光素酶诱导测试
细胞库管理:
- 建立主细胞库(MCB)和工作细胞库(WCB)
- 使用液氮冷冻保存
- 记录传代历史
2. 培养基与试剂
2.1 维持/生长培养基
| 组分 | 浓度 |
|---|---|
| DMEM(Dulbecco改良Eagle培养基) | 基础培养基 |
| 胎牛血清(FBS) | 10% (v/v) |
| Geneticin(G418硫酸盐) | 200-600 µg/mL |
| 青霉素 | 100 IU/mL |
| 链霉素 | 100 µg/mL |
培养条件:
- 温度:37°C
- CO₂:5%
- 湿度:≥95%
2.2 测试培养基
| 组分 | 浓度 |
|---|---|
| DMEM | 基础培养基 |
| 胎牛血清(FBS) | 10% (v/v) |
注意:测试培养基中不含Geneticin和抗生素
2.3 荧光素酶检测试剂
| 试剂 | 规格 |
|---|---|
| 荧光素酶底物 | Promega产品(需遵守使用许可) |
| 细胞裂解缓冲液 | 根据制造商推荐 |
| PBS(磷酸盐缓冲液) | pH 7.4 |
2.4 细胞毒性检测试剂(MTT法)
| 试剂 | 浓度 |
|---|---|
| MTT(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴化物) | 5 mg/mL |
| SDS(十二烷基硫酸钠) | 10% (w/v) |
| 异丙醇 | 室温20min | |
MTT配制:
- CAS号:298-93-1
- 溶解于PBS或培养基(5mg/mL 母液)
- 过滤除菌
SDS裂解液/异丙醇:
- 用于溶解formazan晶体
- 孵育时间:过夜或直至完全溶解
- 异丙醇室温20min震荡
2.5 溶剂与载体
| 溶剂 | CAS号 | 纯度要求 | 最终浓度 |
|---|---|---|---|
| DMSO(二甲基亚砜) | 67-68-5 | ≥99% | 1% (v/v) |
| 无菌水 | - | - | 按需 |
| 培养基 | - | - | 按需 |
3. 对照物质
3.1 阳性对照
肉桂醛(Cinnamic Aldehyde):
| 参数 | 规格 |
|---|---|
| CAS号 | 14371-10-9 |
| 纯度 | ≥98% |
| 储备液浓度 | 6.4 mM(溶于DMSO) |
| 测试浓度范围 | 4-64 µM(5个浓度) |
| 稀释因子 | 2倍系列稀释 |
预期结果:
- EC₁.₅值:7-30 µM
- 在64 µM时诱导倍数:2-8
3.2 阴性对照
| 对照类型 | 物质 | 浓度 |
|---|---|---|
| 溶剂对照 | DMSO | 1% (v/v) |
| 空白对照 | 裂解缓冲液(无细胞) | - |
3.3 熟练度测试物质
实验室在常规使用前必须使用以下10种熟练度物质证明技术能力:
| 序号 | 物质名称 | CAS号 | 预期结果 | EC₁.₅参考范围(µM) | IC₅₀参考范围(µM) |
|---|---|---|---|---|---|
| 1 | 水杨酸 | 69-72-7 | 阴性 | >1000 | >1000 |
| 2 | 乳酸 | 50-21-5 | 阴性 | >1000 | >1000 |
| 3 | 甘油 | 56-81-5 | 阴性 | >1000 | >1000 |
| 4 | 异丙醇 | 67-63-0 | 阴性 | >1000 | >1000 |
| 5 | 乙二醇二甲基丙烯酸酯 | 97-90-5 | 阳性(弱) | 5-125 | >500 |
| 6 | 肉桂醇 | 104-54-1 | 阳性(弱) | 25-175 | >1000 |
| 7 | 2-巯基苯并噻唑 | 149-30-4 | 阳性(中) | 25-250 | >500 |
| 8 | 4-甲基氨基苯酚硫酸盐 | 55-55-0 | 阳性(强) | <12.5 | 20-200 |
| 9 | 甲基二溴戊二腈 | 35691-65-7 | 阳性(强) | <20 | 20-100 |
| 10 | 2,4-二硝基氯苯 | 97-00-7 | 阳性(极强) | <12.5 | 5-20 |
要求:
- 至少8/10物质的预测结果正确
- EC₁.₅和IC₅₀值在参考范围内
4. 受试化学品制备
4.1 储备液配制
可溶性物质:
- 称量适量受试化学品
- 溶解于DMSO至200 mM
- 若不溶于DMSO,使用无菌水或培养基
- 过滤除菌(0.22 µm滤膜)
无明确分子量物质:
- 制备40 mg/mL或4% (w/v)储备液
4.2 系列稀释
12个浓度制备(DMSO中):
| 浓度编号 | 浓度(mM) |
|---|---|
| 1 | 200 |
| 2 | 100 |
| 3 | 50 |
| 4 | 25 |
| 5 | 12.5 |
| 6 | 6.25 |
| 7 | 3.13 |
| 8 | 1.56 |
| 9 | 0.78 |
| 10 | 0.39 |
| 11 | 0.20 |
| 12 | 0.098 |
稀释步骤:
- 在DMSO中制备12个主浓度
- 在含血清培养基中25倍稀释
- 在测试板中再次4倍稀释
- 最终浓度范围:0.98-2000 µM
无分子量物质:
- 最终浓度范围:0.98-4000 µg/mL
仪器设备
1. 细胞培养设备
| 设备 | 规格 |
|---|---|
| CO₂培养箱 | 37°C,5% CO₂,湿度≥95% |
| 生物安全柜 | II级A2型 |
| 倒置显微镜 | 相差功能 |
| 96孔板组织培养处理板 | 无菌、透明底、白色底(发光检测用) |
| 血球计数板 | 细胞计数 |
| 离心机 | 细胞沉淀用 |
| 液氮罐 | 细胞储存 |
2. 检测设备
| 设备 | 规格 |
|---|---|
| 发光检测仪(Luminometer) | 高灵敏度、注射器系统 |
| 酶标仪/分光光度计 | 570 nm检测波长(MTT用) |
| 微孔板振荡器 | 混合用 |
| 移液器 | 0.1-1000 µL范围 |
| 多通道移液器 | 96孔板操作 |
| 微量移液器 | 准确加样 |
操作步骤
第1天:细胞铺板
步骤1:细胞准备
检查细胞状态
- 从工作细胞库复苏细胞或从传代培养中获取细胞
- 确保细胞处于对数生长期
- 细胞活力应>90%
- 融合度:80-90%
收获细胞
- 吸去培养基
- 用PBS洗涤细胞
- 加入适量胰酶-EDTA溶液
- 37°C孵育12-15分钟
- 显微镜下观察细胞脱落
终止消化
- 加入含血清的完全培养基
- 轻柔吹打使细胞分散
细胞计数
- 取适量细胞悬液
- 用血球计数板计数/自动细胞计数仪器
步骤2:调整细胞密度
- 用测试培养基调整细胞密度至 1 × 10⁵ cells/mL
- 确保细胞悬液均匀,无细胞团块
- 保持细胞悬液在室温下,避免沉降
步骤3:铺板
| 板类型 | 孔内容 | 体积 | 细胞数 |
|---|---|---|---|
| 荧光素酶检测板 | 100 µL细胞悬液 | 100 µL | 1×10⁴ cells/孔 |
| 细胞毒性检测板 | 100 µL细胞悬液 | 100 µL | 1×10⁴ cells/孔 |
要点:
- 每个受试物需要1块板(荧光素酶检测,3重复)
- 另设置平行板用于细胞毒性检测
- 阳性对照和溶剂对照在同一板上
- 边缘孔可加PBS或培养基以减少蒸发效应
铺板技巧:
- 边加边轻轻摇动板,确保细胞均匀分布
- 避免产生气泡
- 避免细胞在加样过程中沉降
- 如有沉降风险,可使用多通道移液器并快速操作
步骤4:培养
- 将96孔板置于37°C,5% CO₂培养箱
- 培养24小时
- 直至细胞贴壁并进入对数生长期
- 避免细胞生长至完全汇合
第2天:受试物处理
步骤5:制备受试物稀释系列
储备液制备(当天制备):
- 根据所需浓度计算受试物用量
- 称量或移液适量受试物
- 溶解于DMSO至200 mM
- 对于无分子量物质:制备40 mg/mL溶液
系列稀释:
- 从200 mM储备液开始
- 使用2倍系列稀释制备12个浓度
- 所有稀释在DMSO中进行
- 最终浓度范围:0.098-200 mM
中间稀释:
- 取适量DMSO稀释液
- 在含血清培养基中25倍稀释
- 例如:10 µL DMSO溶液 + 240 µL培养基
最终工作液:
- 在测试板中再次4倍稀释
- 例如:50 µL中间稀释液 + 150 µL培养基
- 最终DMSO浓度:1%
步骤6:制备阳性对照
肉桂醛稀释系列:
| 储备液浓度 | DMSO中主浓度(mM) | 最终测试浓度(µM) |
|---|---|---|
| 6.4 mM | 6.4 | 64 |
| 3.2 | 32 | |
| 1.6 | 16 | |
| 0.8 | 8 | |
| 0.4 | 4 |
制备步骤:
- 制备6.4 mM肉桂醛DMSO储备液
- 2倍系列稀释得到5个主浓度
- 按照与受试物相同的方法稀释
步骤7:制备溶剂对照
- 使用纯DMSO
- 按照与受试物相同的稀释步骤处理
- 最终浓度:1% DMSO
- 每个板设置至少6个重复孔
步骤8:处理细胞
更换培养基:
- 吸去旧培养基
- 每孔加入150 µL新鲜测试培养基(不含G418)
添加受试物:
- 每孔加入50 µL经25倍稀释的受试物或对照
- 最终孔体积:200 µL
- 最终DMSO浓度:1%
- 每个受试物浓度设置3个重复孔
加样顺序建议:
- 从低浓度到高浓度
- 避免交叉污染
- 使用多通道移液器提高效率
- 记录板布局
步骤9:孵育
- 将处理后的板置于37°C,5% CO₂培养箱
- 孵育48小时
- 用铝箔或板盖覆盖以避免挥发
- 避免板间交叉污染
第3天:荧光素酶活性检测
步骤10:细胞裂解
准备裂解缓冲液
- 按制造商推荐配制
- 室温平衡
吸去培养基
- 小心地吸去培养上清
- 避免扰动细胞单层
洗涤细胞
- 每孔加入150 µL PBS
- 轻柔洗涤
- 吸去PBS
加入裂解液
- 每孔加入适量裂解缓冲液(如30 µL)
- 室温孵育至少20分钟
- 确保完全裂解
步骤11:荧光素酶活性检测
发光检测仪设置:
| 参数 | 设置 |
|---|---|
| 注射体积 | 100/50 µL荧光素酶底物 |
| 等待时间 | 1秒 |
| 积分时间 | 2秒 |
| 检测模式 | 发光检测 |
检测步骤:
将板放入发光检测仪
按照预设程序自动运行
仪器自动:
- 向每孔注入荧光素酶底物
- 等待1秒
- 测量发光强度2秒
保存数据用于后续分析
质量控制:
- 确保发光检测仪背景稳定
- 检查无孔间光交叉污染
- 验证阳性和阴性对照响应
第4天:细胞毒性检测(可同时进行)
步骤12:MTT检测
制备MTT溶液:
- 称取MTT粉末
- 溶解于PBS至5mg/mL
- 过滤除菌(0.22 µm)
- 避光储存(现配现用最佳)
MTT孵育:
- 吸去培养基
- 每孔加入100 µL含 0.5mg/mL MTT的新鲜培养基
- 在37°C,5% CO₂条件下孵育3-4小时
- 避免光照
formazan溶解:
- 小心吸去MTT培养基
- 每孔加入100 µL 10% SDS裂解液或者异丙醇
- 孵育过夜(或至少4小时)
- 直至formazan完全溶解
步骤13:吸光度测定
- 在570 nm波长下测量吸光度
- 使用酶标仪或分光光度计
- 记录数据
数据分析
1. 参数计算
1.1 荧光素酶活性诱导倍数
计算公式:
\[诱导倍数 = \frac{L_{sample} - L_{blank}}{L_{solvent} - L_{blank}}\]
其中:
- \(L_{sample}\):受试物孔的发光读数
- \(L_{blank}\):空白孔(无细胞)的发光读数
- \(L_{solvent}\):溶剂对照孔的平均发光读数
1.2 EC₁.₅计算
线性插值公式:
\[EC_{1.5} = (C_b - C_a) \times \frac{1.5 - I_a}{I_b - I_a} + C_a\]
其中:
- \(C_a\):>1.5倍诱导的最低浓度(µM)
- \(C_b\):<1.5倍诱导的最高浓度(µM)
- \(I_a\):\(C_a\)浓度时的诱导倍数
- \(I_b\):\(C_b\)浓度时的诱导倍数
特殊情况:
- 若在最低测试浓度(0.98 µM)已≥1.5倍诱导,则EC₁.₅设为<0.98
1.3 细胞活力计算
公式:
\[活力(\%) = \frac{V_{sample} - V_{blank}}{V_{solvent} - V_{blank}} \times 100\]
其中:
- \(V_{sample}\):受试物孔的吸光度读数
- \(V_{blank}\):空白孔的吸光度读数
- \(V_{solvent}\):溶剂对照孔的平均吸光度读数
1.4 IC₅₀和IC₃₀计算
线性插值公式:
\[IC_x = (C_b - C_a) \times \frac{(100 - x) - V_a}{V_b - V_a} + C_a\]
其中:
- \(x\):50或30(分别对应IC₅₀和IC₃₀)
- \(C_a\):>\(x\)%活力降低的最低浓度
- \(C_b\):<\(x\)%活力降低的最高浓度
- \(V_a\):\(C_a\)浓度时的活力百分比
- \(V_b\):\(C_b\)浓度时的活力百分比
2. 统计分析
2.1 显著性检验
对于每个显示诱导≥1.5倍的浓度:
- 使用双尾Student’s t检验
- 比较3个重复样品与溶剂对照
- 评估p值
- p <0.05视为统计学显著
2.2 重复性评估
重复要求:
- 至少2个独立重复
- 每个重复3个复孔(n=6)
- 如2个重复结果不一致,进行第3个重复(n=9)
- 每个独立重复在不同日期进行
数据一致性:
- 比较不同重复的Imax值
- 比较不同重复的EC₁.₅值
- 评估剂量-反应曲线的一致性
3. 结果解释
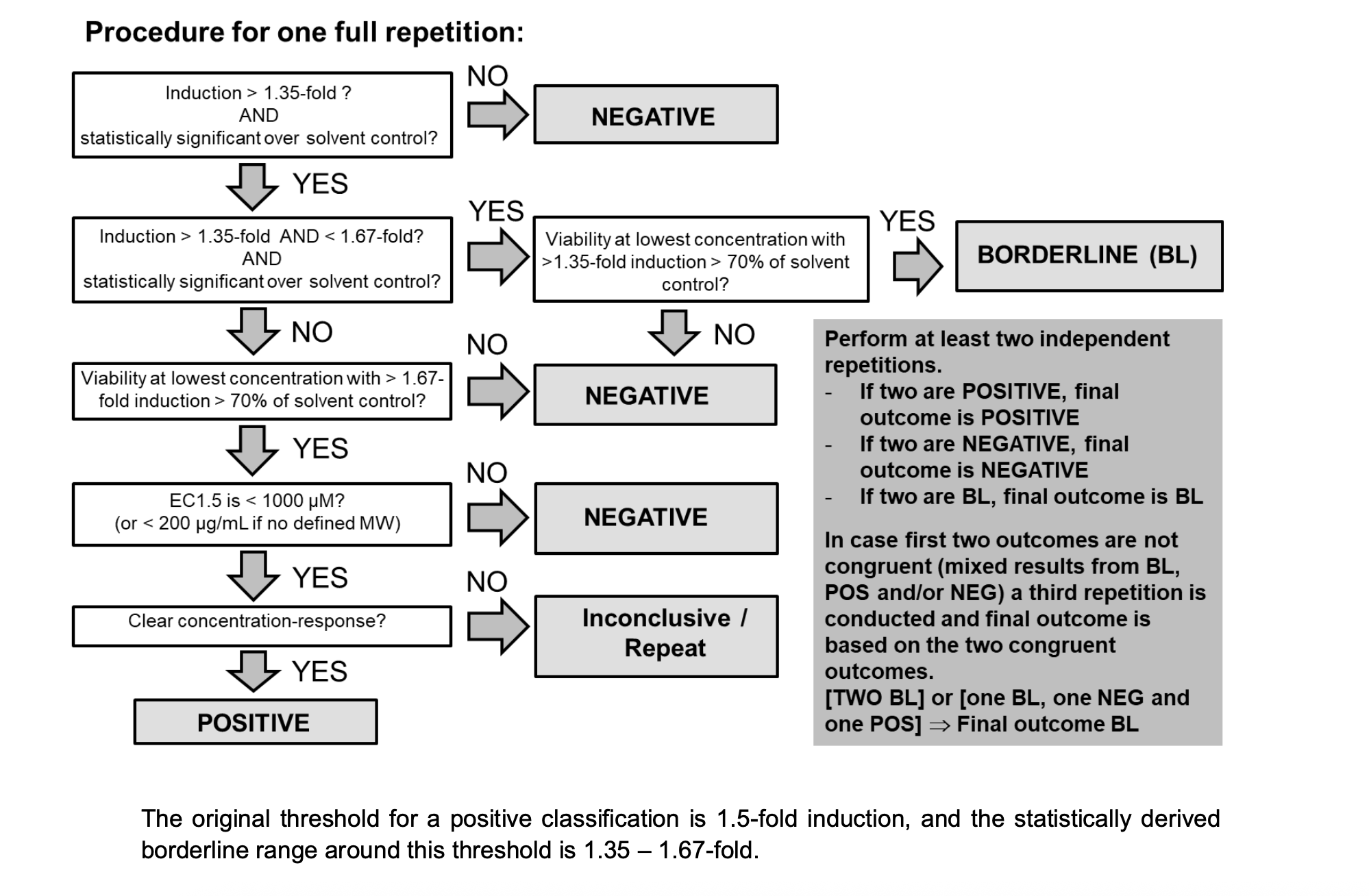
3.1 判定流程图
敏感预测模型的流程图,该模型考虑了临界范围,并通过多次运行得出临界结果。下图KeratinoSens™预测应在既定方法或国际应用技术协会(IATA)的框架内进行考虑,更加详细的整合策略使用
3.2 阳性判定标准
在2/2重复或2/3重复中同时满足以下4个条件:
| 条件 | 标准 |
|---|---|
| 1. Imax | ≥1.5倍且统计学显著(p<0.05) |
| 2. 细胞活力 | 在EC₁.₅确定浓度时>70% |
| 3. EC₁.₅ | <1000 µM(或<200 µg/mL无分子量物质) |
| 4. 剂量-反应关系 | 有明确的剂量依赖性增加 |
注意:
- 4个条件必须同时满足
- 在至少2个重复中满足
- 剂量-反应应清晰可见
3.2 阴性判定标准
不满足阳性判定标准,且:
- 测试浓度达到最大要求(2000 µM或2000 µg/mL)
- 或达到细胞毒性(活力<70%)
- 不属于不确定结果
3.3 不确定结果
以下情况视为不确定:
- 最大测试浓度<1000 µM(或2000 µg/mL)且未达细胞毒性
- 4个阳性条件中前3个满足但无明确剂量-反应关系
- 接近细胞毒性水平诱导(需要进一步测试)
进一步测试建议:
- 调整浓度范围
- 使用更窄的稀释因子(如1.33或√2)
- 重新测试以确定诱导是否发生在细胞毒性之前
4. 质量控制标准
4.1 阳性对照接受标准
肉桂醛(64 µM):
| 参数 | 接受标准 |
|---|---|
| 诱导倍数 | 2-8倍 |
| EC₁.₅ | 7-30 µM |
| 统计显著性 | p<0.05 |
| 细胞活力 | ≥70% |
可接受性:
- 至少一个测试浓度(4-64 µM)诱导显著>1.5倍
- 如果64 µM时诱导不在2-8倍范围,需检查剂量-反应
4.2 溶剂对照接受标准
| 参数 | 接受标准 |
|---|---|
| 变异系数(CV) | <20% |
| 平均发光强度 | 稳定 |
注意:
- CV>20%的结果应丢弃
- 需要重新进行实验
4.3 细胞毒性检测质量
- 溶剂对照活力应接近100%
- 阳性对照的IC₅₀应在预期范围内
- 至少2个连续浓度细胞活力>70%
参考文献
OECD (2012). Series on Testing and Assessment No. 168. The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins.
Emter R, Ellis G, Natsch A (2010). Performance of a novel keratinocyte-based reporter cell line to screen skin sensitizers in vitro. Toxicol Appl Pharmacol 245:281-290.
Natsch A, et al. (2011). The intra- and inter-laboratory reproducibility and predictivity of the KeratinoSens assay. Toxicol In Vitro 25:733-744.
Natsch A, et al. (2013). A dataset on 145 chemicals tested in alternative assays for skin sensitization. J Appl Toxicol 33:1337-1352.
EURL-ECVAM (2014). Recommendation on the KeratinoSens assay for skin sensitisation testing.
DB-ALM (2013) Protocol 155: KeratinoSens.
OECD (2015). Guidance Document No 213. Performance Standards for assessment of proposed similar or modified in vitro skin sensitisation ARE-NrF2 luciferase test methods.